Notre numéro de janvier est maintenant disponible ! – Blog des méthodes

Ce numéro contient les dernières méthodes en matière d’écologie et d’évolution, notamment le suivi automatisé, les œufs non éclos, la quantification de la vision des couleurs et bien plus encore ! Lisez pour découvrir les articles vedettes de ce mois-ci et l’article derrière notre couverture.!
En vedette
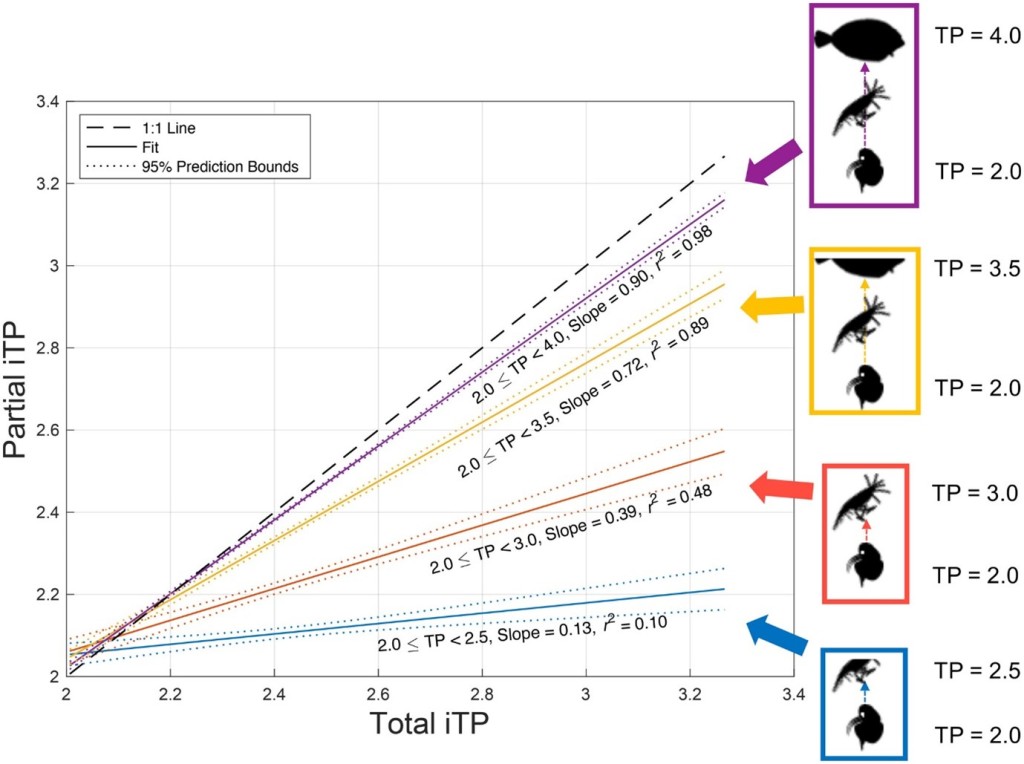
Il y en a deux des approches distinctes pour décrire les répartitions de la biomasse et des espèces dans les réseaux trophiques : l’une pour les considérer comme des niveaux trophiques discrets (TL) ; et l’autre de les considérer comme des positions trophiques continues (TP). Combler le fossé entre ces deux perspectives présente un défi non trivial dans l’intégration de la biodiversité et de la structure du réseau alimentaire. Le déploiement du réseau alimentaire (FNU) est une technique utilisée pour combler cet écart en divisant la biomasse des espèces en TL entiers pour calculer trois indices de complexité, à savoir verticaux (DV), horizontal (DH) et la plage (DR.) diversité (D indices). Bien que notre analyse soit biaisée en faveur des écosystèmes marins, nous avons révélé une relation exponentielle entre l’iTP et DVce qui suggère que l’iTP peut servir d’indicateur mesurable pour DV.
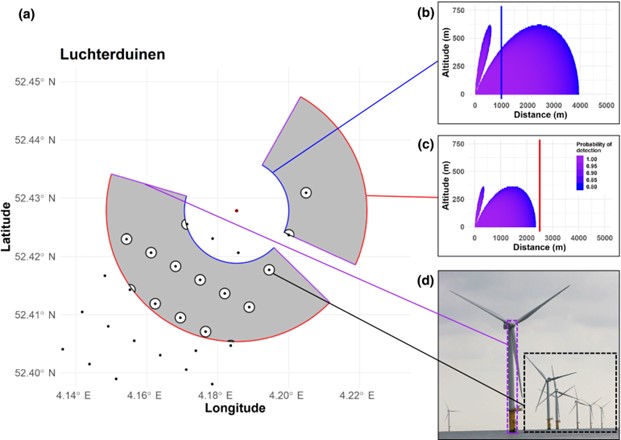
Radar est un outil efficace pour la surveillance continue et la quantification des mouvements aériens des oiseaux et utilisé pour étudier la migration et le comportement de vol local. Cependant, les systèmes dotés d’algorithmes de suivi automatisés ne fournissent pas le niveau de traitement suffisant pour garantir des données fiables. Cet article présente un cadre de post-traitement qui met en œuvre la connaissance du système radar et de la biologie des oiseaux pour filtrer les données et récupérer des données de suivi fiables et de haute qualité. Le cadre fournit un flux de travail logique pour augmenter la fiabilité et la qualité d’un ensemble de données radar sur les oiseaux tout en étant adaptable au système radar et à son environnement. Il s’agit d’une première étape vers la normalisation de la méthodologie de post-traitement des systèmes radar automatisés pour oiseaux, qui peut faciliter les analyses comparatives des mouvements des oiseaux dans l’espace et dans le temps et améliorer la qualité des évaluations d’impact écologique.
Embryon précoce Il a été récemment prouvé que la mortalité est une composante importante de l’échec de la reproduction aviaire. En raison de la difficulté de distinguer les œufs ayant subi une mortalité embryonnaire précoce des œufs non fécondés, cette cause d’échec de la reproduction a été historiquement sous-estimée et négligée. Cet article décrit les méthodes permettant de reconnaître et de collecter les œufs précoces non éclos et ratés provenant de populations d’oiseaux sauvages, d’identifier et d’isoler le matériel embryonnaire dans les œufs non éclos et d’extraire efficacement l’ADN de ces échantillons. L’analyse génétique et éventuellement génomique des embryons qui meurent au début de leur développement pourrait faire progresser de nombreux domaines. Les méthodes décrites ici permettront une exploration plus approfondie des causes jusqu’alors négligées de la mortalité précoce des embryons dans les populations sauvages d’oiseaux, y compris les espèces menacées.
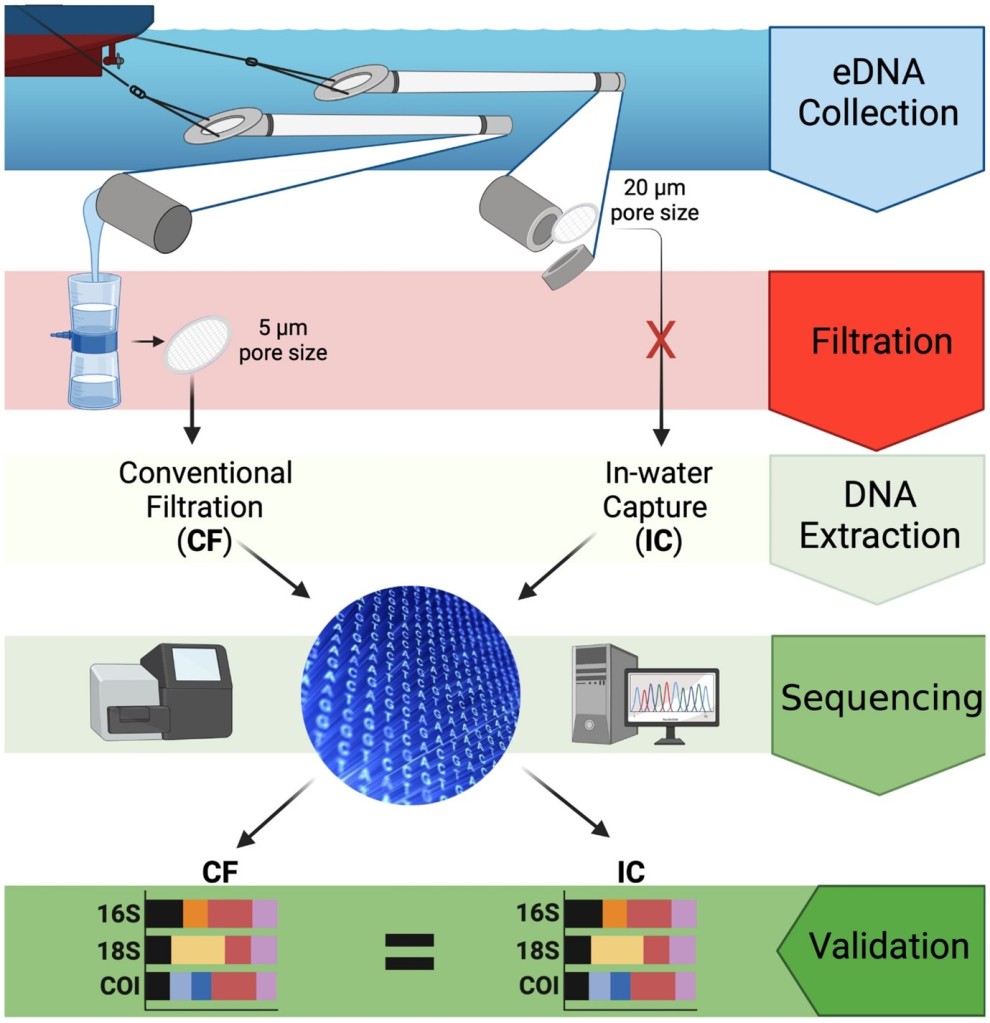
La combinaison L’utilisation d’une méthode d’échantillonnage efficace et d’une analyse à haut débit de l’ADN environnemental (ADNe) peut constituer une approche puissante pour caractériser la biodiversité des écosystèmes aquatiques. Les filets de plancton sont l’une des méthodes les plus anciennes, les plus simples et les moins coûteuses pour la collecte de seston et d’ADNe, mais nécessitent des étapes de filtration laborieuses qui conduisent souvent à un colmatage et/ou à l’introduction de contaminants. Nos résultats démontrent le potentiel prometteur du cul de chalut modifié pour permettre l’isolement pratique et rentable des données de biodiversité dérivées de l’ADNe de tout type de navire (à ≤ 5 nœuds) dans une large gamme d’écosystèmes aquatiques et d’échelles biogéographiques.
Quantifier comment les couleurs stimuler les yeux des animaux est une première étape essentielle dans de nombreux domaines de la biologie, de l’écologie comportementale et visuelle à la neuroéthologie. Bien qu’il existe plusieurs méthodes, leur précision relative n’a pas été testée, ce qui laisse les chercheurs incertains quant aux méthodes les plus précises et à celles qui pourraient être d’une imprécision inacceptable. Ici, cet article compare les mesures de la spectrométrie de réflectance et de quatre techniques basées sur des caméras aux mesures spectroradiométriques de radiance par spectroradiométrie de vérité terrain, en utilisant huit systèmes visuels différents.
Les fourmis sur la couverture
La couverture du mois l’image illustre le mannequin de la taille d’une fourmi utilisé pour fournir une stimulation tactile standardisée aux ouvrières de la fourmi mince Leptothorax acervorum (également représenté). Le mannequin était un aimant recouvert d’or avec deux tiges représentant des antennes et fonctionnant au sein des colonies de fourmis via une plate-forme robotique. Dans leur article, Rüegg, Motes-Rodrigo et al. a développé un nouveau système double combinant cette plate-forme robotique et ce mannequin avec un système de suivi automatisé sur mesure pour évaluer comment la densité conspécifique et la tâche qu’une fourmi effectue à un moment donné influencent les réponses des travailleurs aux stimuli tactiles. Ce système constitue un nouvel outil précieux pour étudier systématiquement le comportement social des insectes sous un contrôle expérimental sans précédent afin de démêler les règles comportementales au niveau individuel qui sous-tendent l’organisation des colonies d’insectes sociaux. Le développement de ce système ouvre de nouvelles voies de recherche pour étudier empiriquement les effets de plus des stimuli complexes sur le comportement social des insectes et a le potentiel d’approfondir considérablement notre compréhension des systèmes collectifs décentralisés. © Bart Zijlstra, DEE, UNIL.